はじめに
ダブレットとは2個の細胞凝集塊のことを言います。フローサイトメトリー(FCM)ではシングルセルレベルで解析を行うため、解析時に必ずダブレット除去を行います。もしダブレット除去を行わずに解析をしてしまうと、再現性が取れなかったり、誤った結論を導いてしまったりする可能性があります。
今回はどんなFCMの解析にも必須なダブレット除去の原理やゲーティングの基礎知識について詳しく解説していきます!
※フローサイトメトリー(FCM)の詳しい原理の解説は以下の記事で行なっています。合わせてご覧ください。
※コンペンセーション(蛍光補正)については以下の記事で解説しています。
前知識のおさらい
FSCとSSCの原理
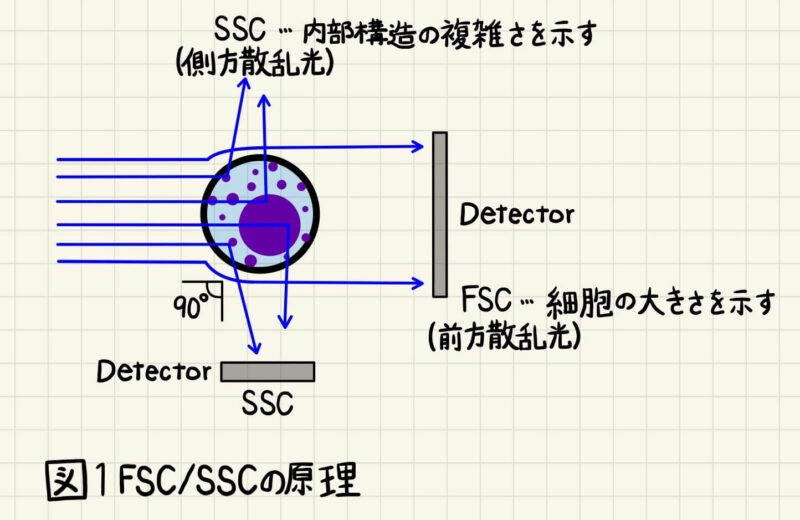
細胞にレーザーを照射すると、前方散乱光(FSC)と側方散乱光(SSC)が検出されます。FSCはレーザーと同じ光軸上に散乱した光で、SSCはレーザーの光軸対して90度に散乱した光のことを言います(図1)。細胞のサイズが大きいほどFSCは大きくなり、細胞内構造が複雑なほどSSCが大きくなります。つまり、FSCは細胞の大きさを、SSCは細胞内構造の複雑さを反映しています。
詳しくは後述しますが、ダブレット除去には散乱光(FSCとSSC)を用います。
ダブレット除去の原理
シングルセルが通過した時
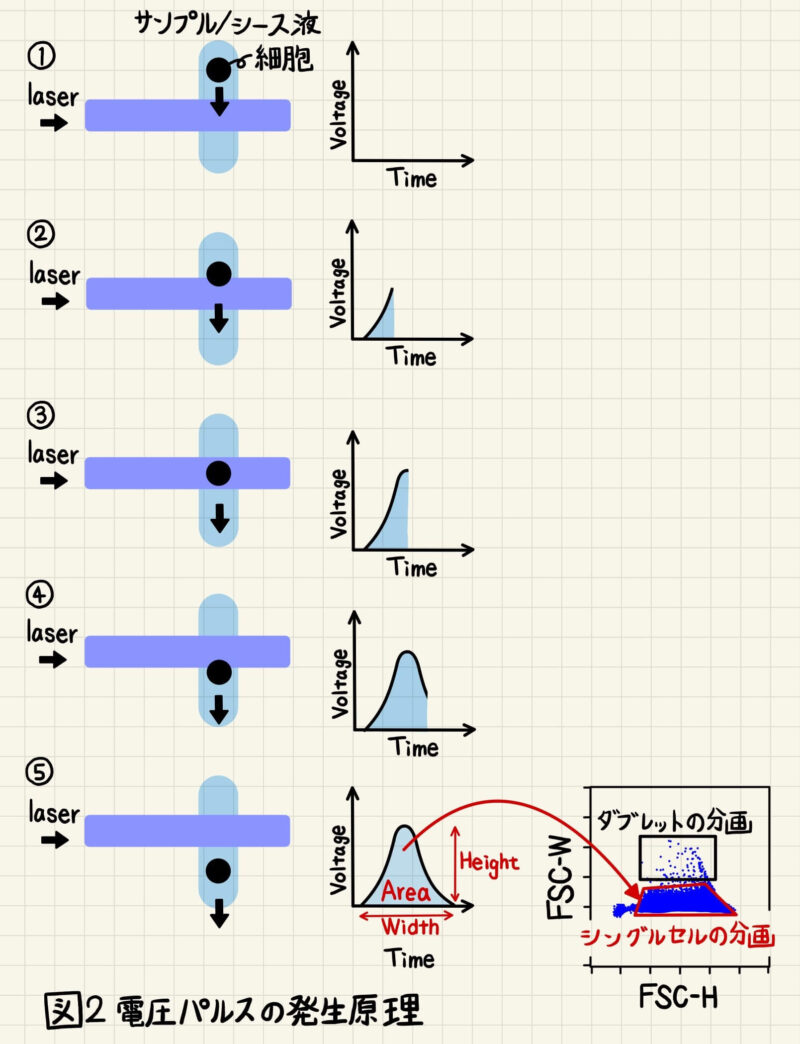
FCMでは散乱光や蛍光を光電子倍増管(PMT; Photo multiplier tube)という検出器で検出します。PMTは散乱光や蛍光を電流に変換するため、PMTからは電圧パルスが発生します(図2)。
細胞にレーザーが当たり始めると、電圧パルスは検出され始めます(図2①、②)。細胞はレーザーの中心を通過した時に最も強い光を発するので、電圧パルスはこの時がピークになります(図2③)。細胞がレーザーから離れ始めると電圧パルスは弱まり(図2④)、完全にレーザーを通過すると電圧パルスは検出されなくなります(図2⑤)。 このようにして、1個の細胞がレーザーを通過した時は図2のような電圧パルスが発生します。
電圧パルスは幅(Width)、面積(Area)、高さ(Hight)の3つの要素で構成されており、Widthは細胞がレーザーを通過する時間、Hightは細胞がレーザーを通過する際に発した一番大きな明るさ、Areaは電圧パルスの面積を表しています(図2)。
ダブレットが通過した時
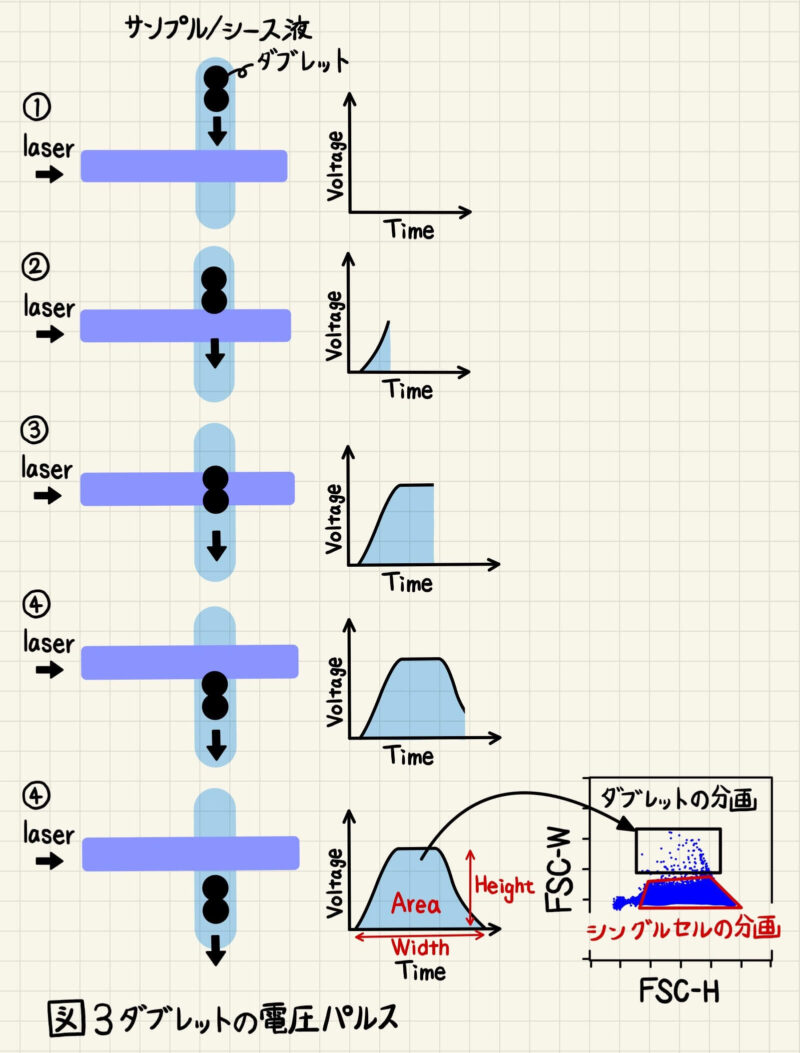
続いてダブレット(=2個の細胞凝集塊)がレーザーを通過した時の電圧パルスを見てみましょう。ダブレットの場合、Hightはシングルセルの場合とほとんど変わりませんが、2個の細胞が連なっているためにレーザーを通過する時間が長くなっていることがわかります(図3②~④)。また、光の総量もシングルセルの時と比較して多くなるため、Areaも大きくなっていることがわかります(図3④)。
したがって、FSC-H vs FSC-Wのプロットに展開した時、同程度のHightの中でもWidth(またはArea)が大きい集団がダブレットの分画になります(図2, 3のFSC-H vs FSC-Wプロットで黒く囲んだところ)。シングルセルの集団は、ダブレットの集団と比較してWidth(またはArea)が小さい分画になります(図2, 3のFSC-H vs FSC-Wプロットで赤く囲んだところ)。
また、トリプレット(3個の細胞凝集塊)やそれ以上の細胞凝集塊も同様の原理で解析対象から排除(=ゲートアウト)します。
ダブレット除去のやり方
これまでみてきたように、ダブレットは電圧パルスのWidthおよびAreaが大きいことを利用して解析対象からゲートアウトします。ここではダブレット除去のやり方を実際の解析の手順に沿って解説していきます。
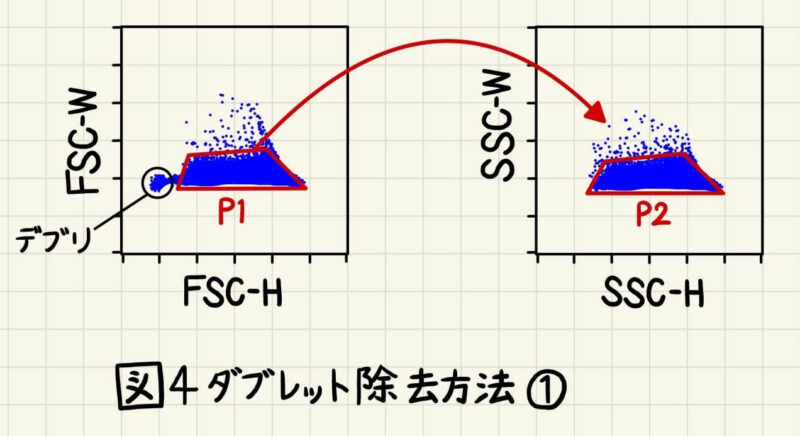
まずは全イベント(シングルセル、ダブレット、細胞凝集塊、死細胞、ゴミなど)をFSC-H vs FSC-Wプロットに展開します。そして前項で解説したように、同程度のHightの中でもWidthが小さい集団をゲーティングします(図4)。この分画を「P1」と呼ぶことにします。(「P1」のPはpopulation(集団)の頭文字です。)また、散乱光が低い場所には死細胞や細胞片、ゴミ(=debris)の集団があることが多く、ダブレット除去と同時にdebrisの分画もゲートアウトします(図4左)。1種類の培養細胞だけを使ったシンプルな解析の場合、このように散乱光の違いのみで死細胞やデブリをゲートアウトできることが多いです。組織片など、様々な種類の細胞が混じっている時の解析では、デブリと細胞集団を区別できない時が多いので、死細胞染色試薬や蛍光色素を用いて目的の細胞以外の集団をゲートアウトしていきます。
次にP1の分画のみをSSC-H vs SSC-Wプロットで展開し、FSCと同様にSSCでもシングルセルをゲーティングします。この分画を「P2」とします。これでダブレット除去完了です。
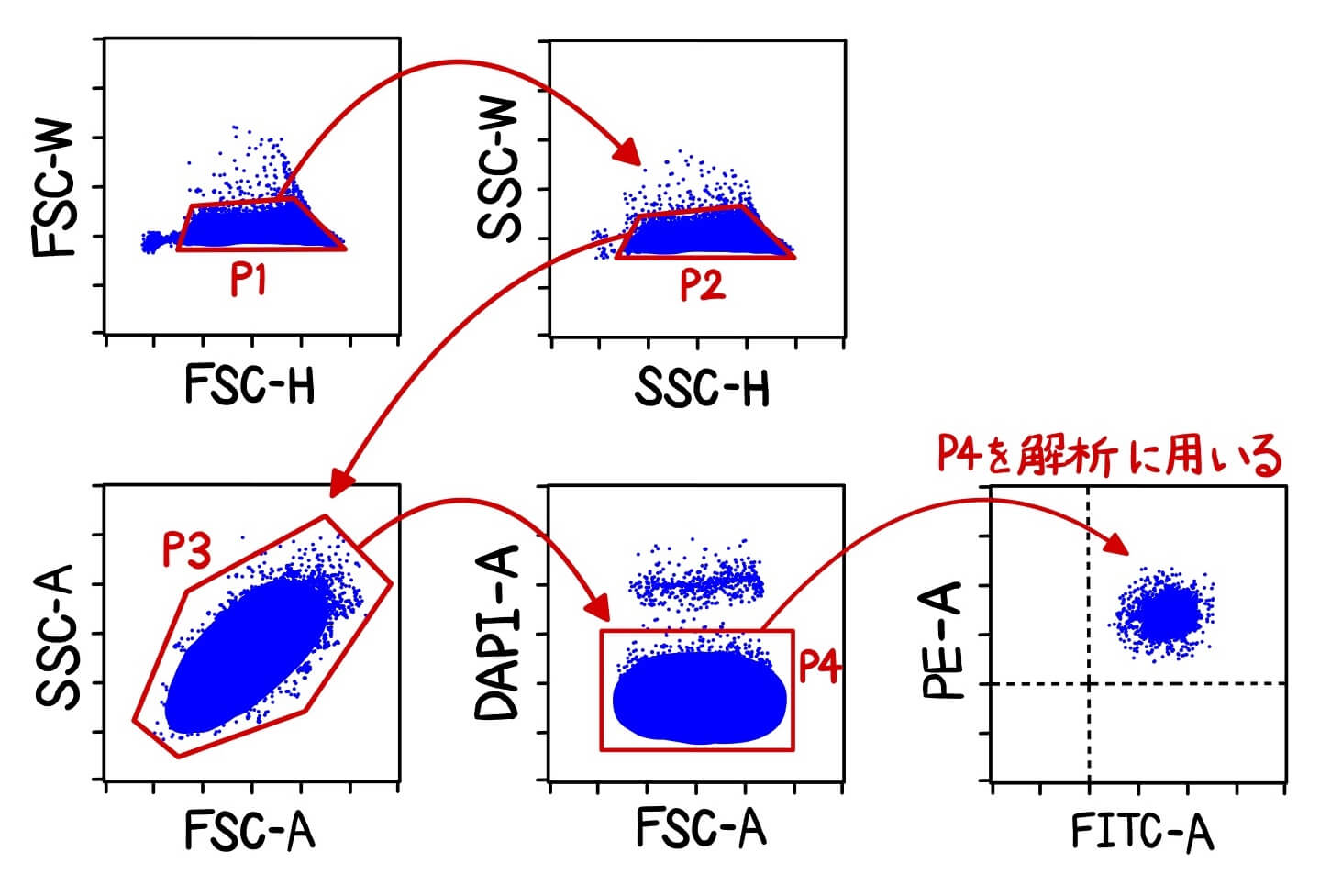
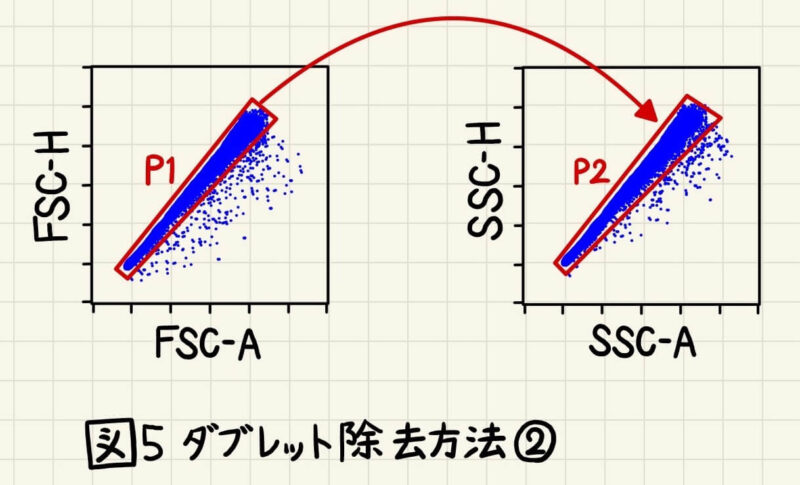
Widthをもたないフローサイトメーターもあり、その場合はFSC-H vs FSC-W → SSC-H vs SSC-Wの代わりに、FSC-H vs FSC-A → SSC-H vs SSC-Aを用いてシングルセルをゲーティングします(図5)。
先ほど解説した通り、ダブレットは光の総量がシングルセルの時と比較して多くなるため、Areaも大きくなります。したがって、同程度のHightの中でもAreaが大きい集団がダブレットの分画になります(図5)。この場合もFSCとSSCの両方光の散乱光を使ってダブレット除去をします。
ゲーティングの例
最後に私が実際によく行っているゲーティングの例を紹介します(図6)。
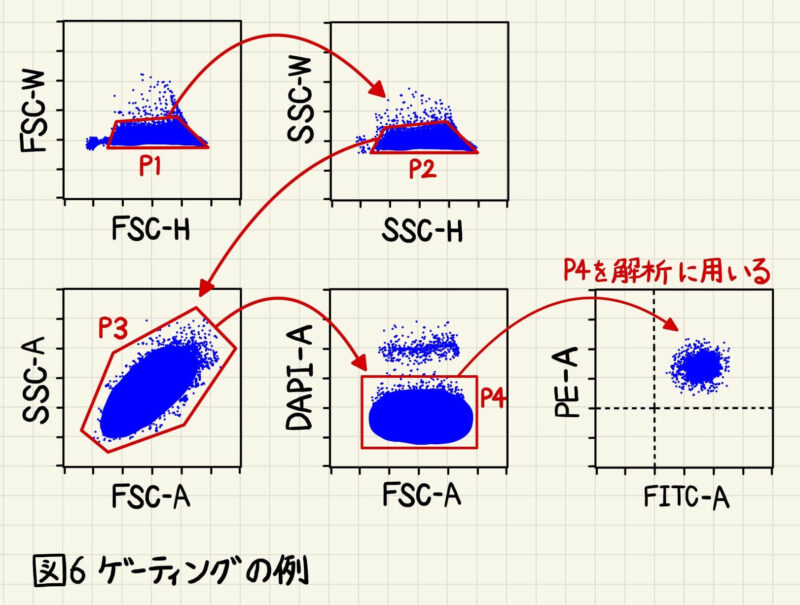
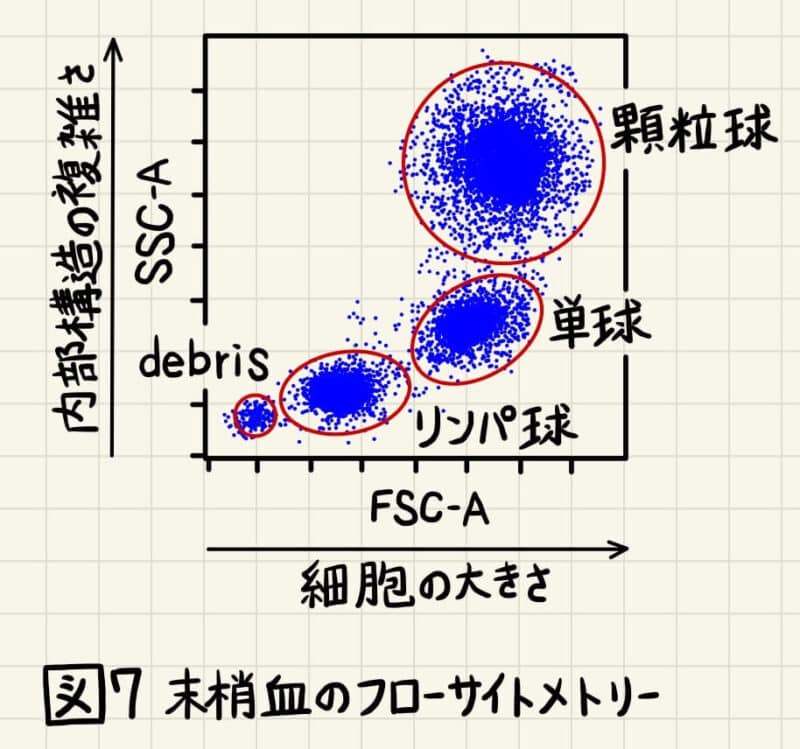
まず前述したようにFSC-H vs FSC-W → SSC-H vs SSC-W(またはFSC-H vs FSC-A → SSC-H vs SSC-A)を用いてダブレット除去をします。続いて、P2をFSC-A vs SSC-Aに展開します。FSC-A vs SSC-Aプロットで展開する意味は、解析対象の細胞集団がFSC-A vs SSC-Aプロットのどこにあるかを確認するためです。1種類の細胞を解析する場合は、図5のように一つの集団しか現れないので、このゲートはなくても解析上困りませんが、解析対象の細胞集団がFSC-A vs SSC-Aプロットのどこの位置あるか確認しておくことは重要です。例えば、末梢血を解析するとFSC-A vs SSC-Aプロットで顆粒球、単球、リンパ球を分離することでき、解析しない細胞集団をゲートアウトすることができます(図7)。
FSC-A vs SSC-Aプロットの次は死細胞染色試薬(DAPI、PI、7-AADなど)を使って死細胞をゲートアウトします。死細胞染色試薬は死細胞を染色するので、染色されてない死細胞染色試薬ネガティブ分画(=生細胞の分画)をゲーティングします。
このようにダブレットや死細胞をゲートアウト除去をした細胞集団(図5のP4の細胞集団)のみを解析に使います。
まとめ
- 特定の細胞集団を解析から除くことをゲートアウトという。
- 細胞がレーザーを通過すると電圧パルスが発生する。
- 電圧パルスは幅(Width)、面積(Area)、高さ(Hight)の3つの要素で構成されており、Widthは細胞がレーザーを通過する時間、Hightは細胞がレーザーを通過する際に発した一番大きな明るさ、Areaは電圧パルスの面積を表す。
- ダブレットはレーザーを通過する時間が長く、光の総量も多くなる(=Width、Areaが大きい)。
- ダブレット除去は「FSC-H vs FSC-W → SSC-H vs SSC-W(またはFSC-H vs FSC-A → SSC-H vs SSC-A)」で行う。